Definition des Begriffs („Was ist FDA 21 CFR Part 11?“)
Die FDA 21 CFR Part 11 ist eine Reihe von Vorschriften, die 1997 von der US-amerikanischen Food and Drug Administration (FDA) eingeführt wurden. Sie definiert die Kriterien, unter denen elektronische Aufzeichnungen und elektronische Signaturen als vertrauenswürdig, zuverlässig und gleichwertig zu Papieraufzeichnungen und handschriftlichen Signaturen betrachtet werden. Im Wesentlichen legt sie die Regeln für die Verwendung elektronischer Systeme in Branchen fest, die von der FDA reguliert werden.
Die Einführung von Part 11 zielte darauf ab, die Prozesse zur Aufzeichnung von Aufzeichnungen in den Bereichen Pharmazie und Life Sciences zu modernisieren und zu rationalisieren. Es sollte die Technologie nutzen, gleichzeitig aber die Datensicherheit und ‑integrität gewährleisten. Der Bedarf an solchen Vorschriften entstand, als diese Branchen vermehrt elektronische Methoden für die Aufzeichnung einführten.
Was sind die Hauptanforderungen von FDA 21 CFR Part 11?
- Elektronische Signaturen: Eine der zentralen Komponenten von FDA 21 CFR Part 11 ist die Verwendung von elektronischen Signaturen. Es werden die Anforderungen für die Verwendung von elektronischen Signaturen festgelegt, um gleichwertig mit handschriftlichen Signaturen zu sein. Dies umfasst die Gewährleistung der Sicherheit und Authentizität dieser Signaturen.
- Audit Trails: FDA 21 CFR Part 11 schreibt die Erstellung von Audit Trails für elektronische Aufzeichnungen vor. Diese Audit Trails dienen als chronologische Aufzeichnung von Systemaktivitäten, die Rückverfolgbarkeit und Verantwortlichkeit ermöglichen.
- Validierung elektronischer Systeme: Unternehmen müssen ihre elektronischen Systeme validieren, um sicherzustellen, dass sie die Anforderungen von Part 11 erfüllen. Dies umfasst umfangreiche Tests und Dokumentationen, um die Zuverlässigkeit und Genauigkeit des Systems nachzuweisen.
- Zugangskontrollen: FDA 21 CFR Part 11 betont auch Zugangskontrollen, um sicherzustellen, dass nur autorisierte Personen Zugang zu elektronischen Aufzeichnungen und Systemen haben. Dies verbessert die Datensicherheit und verhindert unbefugte Änderungen.
Ihr Weg in die Digitalisierung — Entdecken Sie unsere Software
Unsere Digitalisierungslösungen adressieren in erster Linie dokumentenbasierte Prozesse der Herstellung, Produktion und des Qualitätsmanagements. Die Basis des dls | eQMS bildet ein ganzheitliches ECM/DMS-System. Das ECM/DMS-System kann an Ihr bestehendes ERP-System (z. B. SAP) angebunden werden und somit nahezu sämtliche dokumentenbasierte Prozesse im Unternehmen abbilden.
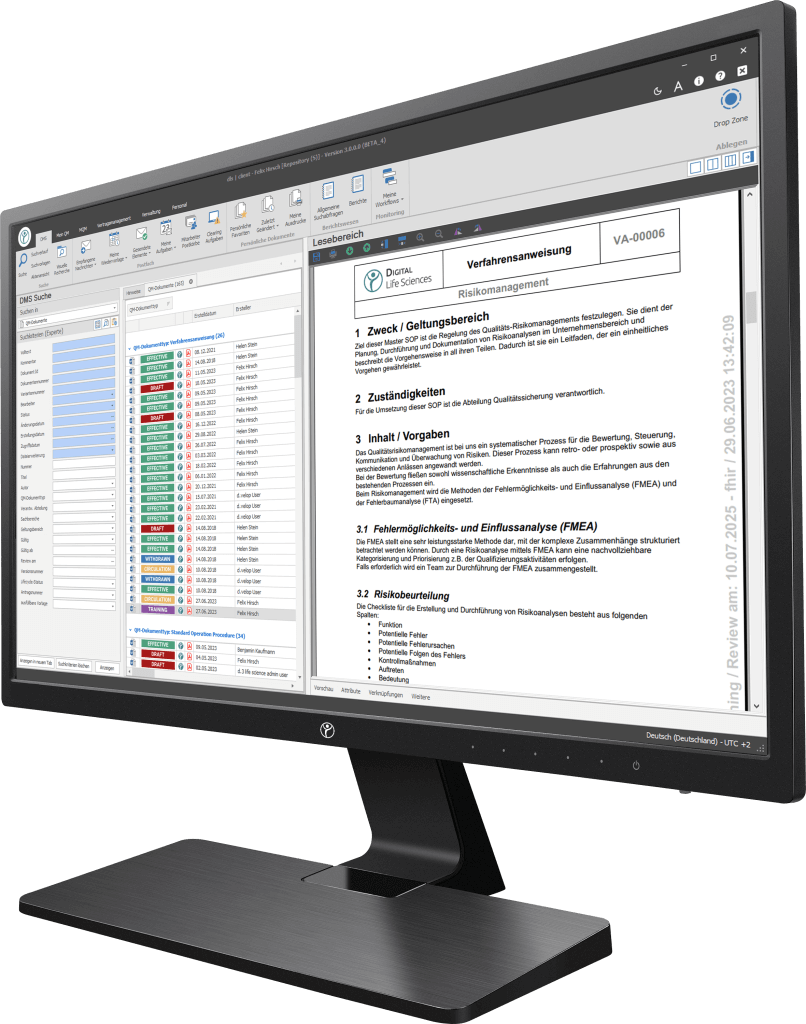
Einhaltung erreichen
Schritte zur Erreichung der Einhaltung von FDA 21 CFR Part 11:
- Bewertung: Beginnen Sie damit, Ihre aktuellen Systeme und Prozesse zu bewerten, um Compliance-Lücken zu identifizieren.
- Validierung: Stellen Sie sicher, dass Ihre elektronischen Systeme validiert sind und alle Software ordnungsgemäß getestet und dokumentiert ist.
- Zugangskontrolle: Implementieren Sie strenge Zugangskontrollen, um elektronische Aufzeichnungen zu schützen.
- Schulung: Schulen Sie Ihr Personal zu den Anforderungen von Part 11 und den besten Praktiken für die elektronische Aufzeichnung.
- Audit Trails: Legen Sie umfassende Audit Trails für elektronische Aufzeichnungen fest.
- Dokumentation: Führen Sie detaillierte Dokumentationen aller Prozesse und Systemvalidierungen.
Vorteile der Einhaltung
Die Einhaltung von FDA 21 CFR Part 11 bietet zahlreiche Vorteile:
- Verbesserte Datensicherheit
- Erhöhte Datensicherheit
- Vereinfachte Aufzeichnungsführung
- Geringeres Risiko von behördlichen Verstößen
- Steigerung der Betriebseffizienz
Fazit
In einem digitalen Zeitalter, in dem Daten König sind, spielt FDA 21 CFR Part 11 eine entscheidende Rolle bei der Gewährleistung der Integrität und Sicherheit elektronischer Aufzeichnungen in den Branchen Pharmazie und Life Sciences. Durch die Einhaltung ihrer Anforderungen können Unternehmen nicht nur regulatorische Standards erfüllen, sondern auch ihre Datenverwaltungspraktiken stärken, was letztendlich zu sichereren und effizienteren Betriebsabläufen führt.
Starten Sie Ihre digitale Transformation mit unseren leistungsstarken, modularen Softwarelösungen
Häufig gestellte Fragen (FAQs)
Für welche Branchen gilt FDA 21 CFR Part 11?
FDA 21 CFR Part 11 gilt hauptsächlich für die Pharmazie‑, Biotechnologie- und Medizinprodukteindustrie.
Ist die Einhaltung von Part 11 obligatorisch?
Ja, die Einhaltung von FDA 21 CFR Part 11 ist für Organisationen, die in seinem Anwendungsbereich tätig sind, obligatorisch.
Welche Konsequenzen hat die Nicht-Einhaltung von FDA 21 CFR Part 11?
Die Nicht-Einhaltung kann zu behördlichen Maßnahmen führen, einschließlich Geldbußen und Produkt-Rückrufen.
Gibt es spezielle Software-Tools, die für die Einhaltung von Part 11 entwickelt wurden?
Ja, es gibt Softwarelösungen, die darauf abzielen, Unternehmen bei der Erreichung und Aufrechterhaltung der Einhaltung von Part 11 zu unterstützen. Einige dieser Tools finden Sie hier.
Wie oft sollten Audit Trails überprüft werden?
Audit Trails sollten regelmäßig überprüft werden, wobei die Häufigkeit von der Risikobewertung des Unternehmens und den Einhaltungsrichtlinien bestimmt wird.
